El transporte inverso de colesterol (ECA) es el proceso mediante el cual el colesterol se elimina de los tejidos periféricos, a través de su incorporación a las lipoproteínas HDL y el posterior transporte al hígado para su excreción biliar.
Las células periféricas, como todas las células no intestinales o hepáticas, no pueden degradar el exceso de colesterol; por lo tanto, para el mantenimiento de la homeostasis celular, la presencia de un mecanismo dedicado a la eliminación del colesterol de las células es esencial. Este mecanismo, dirigido a la recuperación hepática del exceso de colesterol periférico, se denomina "transporte de colesterol inverso" (ECA: transporte de colesterol inverso ).
Vamos a examinar el proceso en detalle.
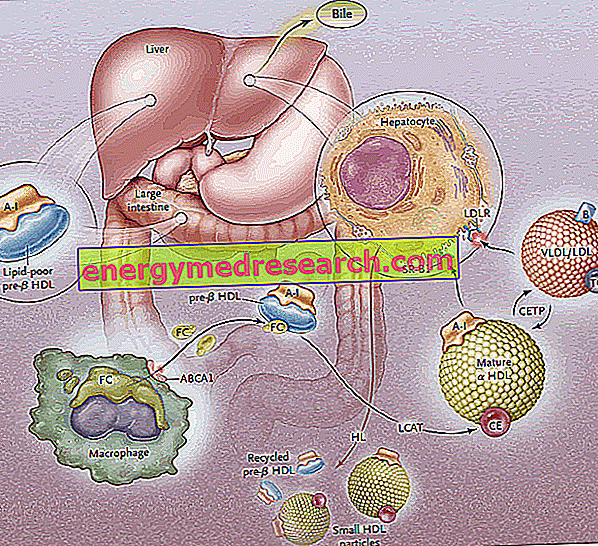
La biosíntesis de las lipoproteínas HDL pasa a través de la síntesis y la secreción inicial de los componentes principales de la proteína (apoproteínas), seguida de la adquisición extracelular de lípidos (fosfolípidos y colesterol) que conduce al ensamblaje y generación de partículas maduras de HDL.
La primera etapa del transporte inverso de colesterol consiste en la producción, por el intestino y el hígado, de precursores discoides de HDL, que en su superficie exponen apoproteínas (principalmente ApoA-I); por lo tanto, se liberan los precursores de la HDL llamada pre-B-HDL, que incorporan cantidades muy pequeñas de colesterol y lípidos, especialmente fosfolípidos. La presencia de estas moléculas precursoras a nivel periférico promueve la transferencia del exceso de colesterol libre (FC), filtrado de las células de los tejidos periféricos, a la apo AI, a través de la intervención de un transportador de membrana llamado casete A1 de unión a ATP (ABCA1). ). Este transportador se encuentra en la superficie celular y en las membranas de Golgi, y puede transportar los lípidos desde el aparato de Golgi a la membrana celular, facilitando su flujo de salida. En este punto, tan pronto como el colesterol libre ingresa a la HDL nativa, interviene una enzima plasmática de origen hepático, llamada plasma-colesterol aciltransferasa o más simplemente LCAT; esta enzima convierte el colesterol libre incorporado en pre-B-HDL en ésteres de colesterol, transformando el pre-B-HDL en su forma madura de α-HDL; en la práctica, la acumulación continua de colesterol en el núcleo de la lipoproteína convierte el HDL discoide en partículas esféricas y gruesas, que pueden adquirir más apoproteínas de las partículas de lipoproteína ricas en triglicéridos y mezclarse entre sí. En todo el proceso, la apolipoproteína AI juega un papel clave, estimulando tanto la actividad del transportador ABCA1 como la del LCAT. Debido a que ApoAI es la apolipoproteína más ampliamente representada en HDL, su concentración en plasma está directamente relacionada con los niveles de colesterol HDL.
NOTA: el proceso de esterificación es esencial para prevenir la redifusión de colesterol de HDL a la membrana plasmática; este mecanismo explota el ácido graso en la posición dos presente en las moléculas de fosfatidilcolina.
El proceso de esterificación mediado por LCAT luego transforma las moléculas pre-B-HDL en su forma esférica α-HDL "madura". Estas lipoproteínas se transportan luego al hígado, donde liberan colesterol, de acuerdo con dos rutas distintas.
En el primer caso, las HDL ricas en colesterol esterificado rinden este lípido a las lipoproteínas ricas en triglicéridos (lipoproteínas de muy baja y baja densidad), luego son interceptadas por el hígado por receptores específicos (LDL-R) y se eliminan de la circulación. El objetivo es canalizar el colesterol periférico hacia el hígado a través del sistema receptor de LDL, de este modo "descargando" el HDL del exceso de colesterol al nivel periférico, para que esté disponible nuevamente para recibirlo de los tejidos; vaciados de colesterol, los HDL aceptan triglicéridos a cambio y esto se hace gracias a la proteína de transferencia de éster de colesterol (CETP). La tarea de esta proteína es, por lo tanto, promover la redistribución y equilibrio de los ésteres de colesterol y triglicéridos entre los restos de HDL, LDL, IDL, VLDL, quilomicrones y qunomicrones, lo que lleva, como resultado neto, a un enriquecimiento en triglicéridos de HDL, en detrimento de los ésteres de colesterol, y una reducción en el tamaño de HDL.
La segunda vía involucra a los receptores hepáticos SR-B1 para HDL ricos en colesterol esterificado, en ausencia de una degradación concomitante de la porción de proteína de HDL, que luego se recicla. En la práctica, esta enzima le permite vaciar el HDL de su contenido y regenerar un nuevo pre-B-HDL. Sin embargo, parte de HDL y ApoA-I se internalizan y degradan a nivel lisosomal, tanto en células hepáticas como renales. La captación mediada por SR-B1 se hace más eficiente por la actividad de la lipasa hepática, capaz de remodelar las HDL hidrolizando los fosfolípidos de la superficie y permitiendo el flujo de colesterol esterificado por el núcleo de lipoproteínas hacia la membrana plasmática (se hipotetiza, entre otro, que también el ApoE está involucrado en la captación selectiva, ya que los ratones deficientes para el gen ApoE presentan una reducción en la eficacia de esta ruta). SR-BI se expresa predominantemente en el hígado, suprarrenal y ovario.