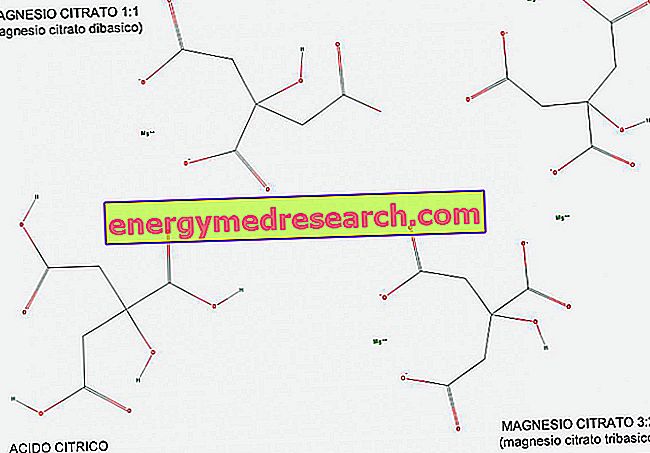
Un ácido tribásico (o triprótico) es un ácido que posee tres iones de hidrógeno para ser donados en una reacción ácido-base. Con la ayuda de la figura, podemos ver cómo el ácido cítrico es un ejemplo de ácido tribásico, ya que tiene tres grupos carboxílicos COOH que pueden producir fácilmente H hidrógeno.
El citrato de magnesio existe en proporción 1: 1 (1 molécula de magnesio por molécula de citrato) y en proporción 3: 2 (3 moléculas de magnesio por 2 moléculas de citrato).
El citrato de magnesio 1: 1 se llama dibásico porque es una sal dibásica de ácido cítrico; de hecho, tiene 2 grupos básicos univalentes (COO-) por molécula, derivados de los 2 grupos carboxílicos que abandonaron su hidrógeno durante la reacción.
El magnesio 3: 2, por otro lado, se llama tribásico porque tiene 3 grupos básicos univalentes (COO) por molécula, derivados de los 3 grupos carboxílicos que abandonaron su hidrógeno durante la reacción.
El citrato de magnesio tribásico es claramente más rico en magnesio (+ 42, 6% en peso) que el citrato de magnesio dibásico; además, es más alcalinizante, ya que puede aceptar tres iones de hidrógeno H + contra los dos aceptados por el dibásico. Sin embargo es menos soluble en agua.



