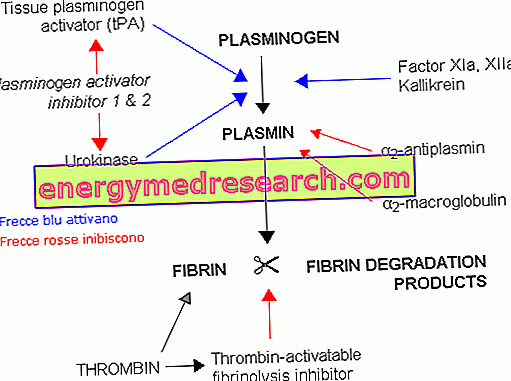
La plasmina es la enzima prominente del sistema fibrinolítico, un proceso biológico utilizado para disolver los coágulos de fibrina que se forman como resultado de las lesiones vasculares. Estos intrincados polímeros de fibrina están diseñados para crear una especie de tapón anti-hemorrágico, que incorpora células sanguíneas (plaquetas, glóbulos blancos y glóbulos rojos) y varias proteínas plasmáticas. Entre estos también se encuentra el precursor de plasmina inactivo, llamado plasminógeno, que tiene una alta afinidad por las moléculas de fibrina. Gracias a esta característica, el plasminógeno se concentra sobre todo en los sitios de almacenamiento de fibrina (como los coágulos).
El plasminógeno se convierte en plasmina mediante la intervención de activadores naturales específicos, incluida la uroquinasa (u-PA) y el activador tisular del plasminógeno (t-PA). A pesar del nombre, este último es más activo a nivel circulatorio (generalmente se secreta muy lentamente para permitir los procesos de reparación de lesiones), mientras que la uroquinasa es más activa a nivel tisular. Por lo tanto, de manera similar a lo que se ha visto para la coagulación, en la fibrinólisis se puede distinguir una vía intrínseca y una vía extrínseca, ambas consisten en una serie de reacciones en cascada.
El sistema fibrinolítico limita el daño derivado de la deposición excesiva de fibrina y la consiguiente obstrucción de los vasos, debido a coágulos anormales (llamados trombos).
Con un mecanismo proteolítico, la plasmina recién formada divide la fibrina en productos de degradación solubles. La actividad proteasa de la plasmina es similar a la de la tripsina pancreática y es poco específica (además del plasminógeno, también es activa en otros sustratos, como los constituyentes del complemento plasmático, los factores de coagulación V y VIII, el fibrinógeno y algunas hormonas de la naturaleza). proteínas, tales como ACTH, glucagón y hormona de crecimiento). A partir de la proteólisis del fibrinógeno y la fibrina, se originan fragmentos peptídicos de tamaños variables, denominados complejos de FDP ( fibrinógeno y productos de degradación de la fibrina ).
Al igual que en la cascada de coagulación, también existen inhibidores específicos para la cascada proteolítica. En su ausencia, de hecho, produciría una demolición exagerada de fibrinógeno, fibrina y otras proteínas importantes para la coagulación, con el peligro de sangrado grave.
Durante la formación del coágulo, la síntesis de plasmina generalmente es inhibida por sustancias específicas liberadas por plaquetas activadas y por células locales. Solo en presencia de fibrina o estasis debido a oclusión venosa, el endotelio libera una cantidad en exceso de activadores de plasminógeno, que se unen a receptores específicos que producen fibrinólisis. Mientras que en los otros sitios del cuerpo los receptores de plasmina para los inhibidores relativos (la antiplasmina) están libres, a nivel del coágulo se unen mediante la unión con la fibrina; De este modo, la plasmina está protegida por su acción y, por lo tanto, es libre de llevar a cabo su actividad.
Algunos fármacos, como la estreptoquinasa, aumentan la actividad fibrinolítica y, como tales, son útiles para la hipercoagulabilidad de la sangre (trombosis). Por otro lado, también hay fármacos antifibrinolíticos, particularmente útiles en pacientes con hemorragias por hiperfibrinolisis.



