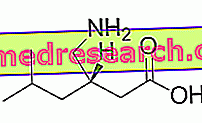
¿Qué es y para qué se utiliza Erivedge - vismodegib?
Erivedge es un medicamento para el tratamiento de tumores que contiene el principio activo vismodegib . Está indicado para el tratamiento de pacientes adultos con carcinoma de células basales (una forma de cáncer de piel de crecimiento lento) en estadios avanzados cuando el tumor es metastásico (se ha diseminado a otras partes del cuerpo) y causa síntomas o está localmente avanzado. (es decir, ha comenzado a extenderse a áreas cercanas) y no se considera apropiado proceder con cirugía o radioterapia (tratamiento de radiación).
¿Cómo utilizar Erivedge - vismodegib?
Erivedge solo se puede obtener con receta médica. Solo debe recetarlo un médico especialista con experiencia en el tratamiento del carcinoma de células basales o bajo la supervisión de ese médico. El medicamento está disponible en cápsulas (150 mg). La dosis recomendada es una cápsula una vez al día. El beneficio del tratamiento continuado debe revisarse periódicamente y la duración óptima de la terapia dependerá del beneficio y los efectos indeseables que informe cada paciente. Para más información, consulte el prospecto.
¿Cómo funciona Erivedge - vismodegib?
El principio activo de Erivedge, vismodegib, actúa inhibiendo la llamada "vía de señalización de Hedgehog", que generalmente contribuye a la regulación de las etapas tempranas del desarrollo celular en el feto y ciertos procesos celulares en adultos. En el carcinoma de células basales, la vía de señalización de Hedgehog se vuelve inusualmente activa y determina el crecimiento y la diseminación de las células tumorales. Vismodegib se une a una proteína llamada "SMO", que participa en la activación de la vía de señalización de Hedgehog. Al unirse a la SMO, vismodegib bloquea esta vía y retrasa el crecimiento y la diseminación de las células tumorales en el carcinoma de células basales.
¿Qué beneficio ha demostrado tener Erivedge - vismodegib durante los estudios?
Erivedge se ha estudiado en un estudio principal en el que participaron 104 pacientes con carcinoma de células basales localmente avanzado o metastásico. Los pacientes fueron tratados con Erivedge hasta que la enfermedad empeoró o hasta que ya no pudieron tolerar la terapia o hasta que se retiraron del estudio. Erivedge no se comparó con otro tratamiento. La medida principal de la efectividad fue la respuesta al tratamiento, basada en una reducción de al menos el 30% de la masa tumoral o la desaparición de todos los signos del tumor (la tasa de respuesta objetivo). Aproximadamente el 33% (11 de 33) de los pacientes con cáncer metastásico y el 48% (30 de 63) de los pacientes con cáncer localmente avanzado respondieron a la terapia.
¿Cuál es el riesgo asociado a Erivedge - vismodegib?
Los efectos secundarios más comunes de Erivedge (que pueden afectar a más de 3 de cada 10 personas) son espasmos musculares, alopecia (pérdida de cabello), disgeusia (trastornos del sentido del gusto), pérdida de peso, fatiga, náuseas y diarrea. Para ver la lista completa de todos los efectos secundarios informados con Erivedge, consulte el prospecto. Erivedge no debe utilizarse en mujeres embarazadas o en periodo de lactancia o en pacientes en edad fértil que no cumplan con el programa específico de prevención de embarazos desarrollado para Erivedge. No debe administrarse en combinación con productos que contengan la hierba de San Juan (un medicamento a base de hierbas que se usa para tratar la depresión). Para obtener una lista completa de las limitaciones, consulte el prospecto.
¿Por qué se ha aprobado Erivedge - vismodegib?
El Comité de la Agencia de Medicamentos de Uso Humano (CHMP) decidió que los beneficios de Erivedge son mayores que sus riesgos y recomendó que se aprobara para su uso en la UE. El Comité consideró que los beneficios de Erivedge se habían demostrado en pacientes con carcinoma metastásico y avanzado localmente. También se tuvo en cuenta que los efectos indeseables son manejables, aunque los datos sobre los pacientes con carcinoma metastásico son limitados. Debido a que Erivedge suspende el mecanismo involucrado en las primeras etapas del desarrollo fetal, el CHMP concluyó que se deben tomar las medidas adecuadas para prevenir el embarazo durante el tratamiento y después de la interrupción, tanto en hombres como en mujeres tratadas con Erivedge. Erivedge obtuvo una "aprobación condicional". Esto significa que habrá más información disponible sobre el medicamento en el futuro, que la compañía debe proporcionar. Cada año, la Agencia Europea de Medicamentos revisará la nueva información disponible y este resumen se actualizará en consecuencia.
¿Qué información todavía se espera para Erivedge - vismodegib?
Como se ha emitido la aprobación condicional para Erivedge, la compañía que lo comercializa proporcionará los resultados de un estudio de seguridad integral en pacientes con enfermedad metastásica.
¿Qué medidas se han adoptado para garantizar un uso seguro y eficaz de Erivedge - vismodegib?
Se ha desarrollado un plan de gestión de riesgos para garantizar que Erivedge se utilice de la forma más segura posible. Sobre la base de este plan, la información de seguridad se ha incluido en el resumen de las características del producto y el prospecto de Erivedge, incluidas las precauciones adecuadas que deben seguir los profesionales de la salud y los pacientes. Además, la compañía desarrollará un programa de prevención del embarazo que proporcione material de información sobre los riesgos para el feto, incluido un recordatorio, para los pacientes y profesionales de la salud que pueden recetar y distribuir Erivedge. La compañía informará sobre cualquier embarazo que tenga lugar durante el tratamiento con Erivedge y supervisará el resultado.
Más información sobre Erivedge - vismodegib
El 12 de julio de 2013, la Comisión Europea otorgó una autorización de comercialización válida para Erivedge en toda la Unión Europea. Para obtener más información sobre el tratamiento con Erivedge, lea el prospecto (también parte del EPAR) o consulte a su médico o farmacéutico. Última actualización de este resumen: 01-2015.