¿Qué es Kisplyx - Lenvatinib y para qué sirve?
Kisplyx es un medicamento contra el cáncer que se usa para tratar a pacientes adultos con carcinoma avanzado de células renales (un tipo de cáncer de riñón) que se han tratado previamente con otro tipo de cáncer llamado "inhibidor del factor de crecimiento vascular endotelial (VEGF)".
Kisplyx se usa en combinación con otro medicamento contra el cáncer llamado everolimus. Kisplyx contiene el principio activo lenvatinib.
¿Cómo se usa Kisplyx - Lenvatinib?
Kisplyx solo puede obtenerse con receta médica y el tratamiento debe ser iniciado y supervisado por un médico con experiencia en el uso de medicamentos contra el cáncer.
Kisplyx está disponible en cápsulas (4 mg y 10 mg). La dosis recomendada es de 18 mg (obtenida al administrar una cápsula de 10 mg y dos cápsulas de 4 mg), una vez al día, todos los días a la misma hora, en combinación con 5 mg de everolimus una vez al día. Puede ser necesario reducir la dosis o suspender temporalmente el tratamiento con Kisplyx si se producen ciertos efectos indeseables. El tratamiento debe continuar hasta que el paciente se beneficie o hasta que los efectos indeseables se vuelvan insostenibles. La dosis de Kisplyx debe disminuirse en pacientes con insuficiencia renal o hepática grave.
Para obtener más información, consulte el prospecto de Kisplyx y el medicamento que contiene everolimus.
¿Cómo funciona Kisplyx - Lenvatinib?
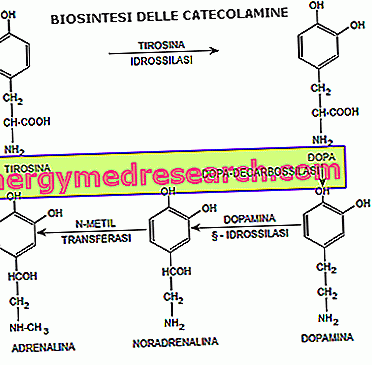
El principio activo de Kisplyx, lenvatinib, es un inhibidor de la tirosina quinasa. Esto significa que bloquea la actividad de las enzimas conocidas como tirosina quinasas. Estas enzimas se pueden encontrar en algunos receptores (como los receptores VEGF, FGFR, PDGF, KIT y RET) en las células cancerosas, donde activan diferentes procesos, incluida la división celular y el crecimiento de nuevos vasos sanguíneos. Al bloquear estas enzimas, el lenvatinib puede prevenir la formación de nuevos vasos sanguíneos, lo que interrumpe el suministro de sangre que favorece el crecimiento de las células cancerosas y reduce el crecimiento del tumor.
¿Qué beneficio ha demostrado tener Kisplyx - Lenvatinib durante los estudios?
La actividad de Kisplyx se evaluó durante un estudio importante en el que participaron 153 pacientes adultos con carcinoma avanzado de células renales que habían mostrado un empeoramiento de la enfermedad a pesar del tratamiento con un inhibidor de VEGF. El estudio comparó la combinación de Kisplyx y everolimus con Kisplyx o simplemente everolimus, respectivamente. La medida principal de la efectividad fue el tiempo de supervivencia del paciente sin empeoramiento de la enfermedad (supervivencia libre de progresión). Los pacientes que habían tomado la combinación de Kisplyx y everolimus vivieron un promedio de 14.6 meses sin mostrar un empeoramiento de la enfermedad, en comparación con los 7.4 meses de los pacientes que solo habían tomado Kisplyx y los 5.5 meses de los que habían recibido Asumido solo everolimus.
¿Cuáles son los riesgos asociados con Kisplyx - Lenvatinib?
Los efectos secundarios más comunes con Kisplyx (que pueden afectar a más de 3 de cada 10 personas), tanto en combinación con everolimus como solo, son diarrea, hipertensión, fatiga, pérdida de apetito y peso, vómitos, náuseas y proteinuria (presencia de proteínas en la orina), estomatitis (inflamación de la mucosa de la boca), dolor de cabeza, disfonía (trastorno de la voz), síndrome de eritrodisestesia palmo-plantar (también llamado síndrome mano-pie, que se manifiesta con erupción y entumecimiento de la palmas de las manos y plantas de los pies), edema periférico (hinchazón, especialmente en los tobillos y los pies) e hipercolesterolemia (niveles de colesterol [un tipo de lípido] elevados en la sangre).
Los principales efectos secundarios graves son la insuficiencia renal y la insuficiencia renal; Trastornos del corazón y la circulación, como insuficiencia cardíaca y coágulos de sangre en las arterias, que causan un accidente cerebrovascular o un ataque cardíaco; hemorragia cerebral o hemorragia de un tumor dentro del cráneo; uno conocido como "síndrome de encefalopatía posterior reversible", caracterizado por dolor de cabeza, confusión, convulsiones y pérdida de visión; insuficiencia hepática. Para ver la lista completa de todos los efectos secundarios informados con Kisplyx, consulte el prospecto. Para ver la lista completa de todos los efectos secundarios notificados con everolimus, consulte el prospecto del medicamento correspondiente que lo contiene.
El uso de Kisplyx está contraindicado en mujeres que amamantan. Para obtener una lista completa de las limitaciones, consulte el prospecto.
¿Por qué se ha aprobado Kisplyx - Lenvatinib?
Los pacientes con carcinoma de células renales avanzado que se han sometido previamente a un tratamiento tienen resultados negativos e importantes necesidades médicas no satisfechas. Se ha demostrado que Kisplyx, usado en asociación con everolimus, causa un aumento significativo en el período sin empeorar la enfermedad. El perfil de seguridad de Kisplyx en combinación con everolimus es similar al de los dos medicamentos utilizados como monoterapia y los efectos secundarios se consideran manejables. El Comité de la Agencia de Medicamentos para Uso Humano (CHMP), por lo tanto, decidió que los beneficios de Kisplyx son mayores que sus riesgos y recomendó que se aprobara para su uso en la UE.
¿Qué medidas se han adoptado para garantizar un uso seguro y eficaz de Kisplyx - Lenvatinib?
Las recomendaciones y precauciones que deben seguir los profesionales de la salud y los pacientes para el uso seguro y eficaz de Kisplyx se han incluido en el resumen de las características del producto y en el prospecto.
Más información sobre Kisplyx - Lenvatinib.
Para obtener el EPAR completo de Kisplyx, consulte el sitio web de la Agencia: ema.europa.eu/Encuentre medicamentos / Medicamentos humanos / Informes públicos europeos de evaluación. Para obtener más información sobre el tratamiento con Kisplyx, lea el prospecto (también parte del EPAR) o póngase en contacto con su médico o farmacéutico.